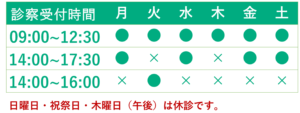
診察ご予約はこちら
COVID-19の発症、経過及び生体の免疫とウイルスについて述べてみます。
2019年12月に中国の武漢で原因不明の重症肺炎を発症したcoronavirus disease 19(COVID-19)新型コロナウイルス感染症は、SARSコロナウイルス2型(SARS-CoV-2)により引き起こされる感染症です。この感染症は、武漢で増え続け未曾有のパンデミック感染症となり、世界中の社会生活や経済に甚大な影響を及ぼしています。SARS-CoV-2はウイルス変異を繰り返し、抜け目がなく、謎が多いウイルスで未だに収束したとは言い難い現状です。現在までにCOVID-19の多くの報告がなされていますが、非常に難しい語句や表現での説明の為理解しにくい面が少なからずあります。そういう訳で、臨床外科医からみたCOVID-19を思考し、少しでも皆さんがご理解いただけるように私なりの見解を交えつつまとめてみました。
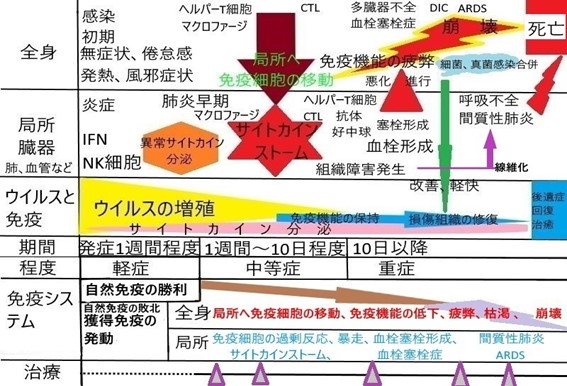
図1にCOVID-19の経過と免疫系及び症状との関係を示します。SARS-CoV-2の潜伏期間は、1~14日間とされています。WHOによると、平均5日程度で発症します。オミクロン株では平均約3日程度です。 COVID-19発症から一週間程度でウイルスが増殖し、次第にウイルスが減少し始める頃から、宿主の免疫反応が活発になります。ウイルス感染して10日間を過ぎ、症状がなければ感染力はないと考えられています。現時点では、SARS-CoV-2に対して十分に満足できる治療方法はないものの、感染者の80%は、無症状か軽症で経過しますが、約20%が重症肺炎となり、5~6%が致死的な急性呼吸促迫症候群(ARDS)となります。尚、日本、米国、中国の感染者の致死率は、0.2%、1.1%、2.2%です。 そこでウイルスについて少し説明します。ウイルスは、自分自身で増殖する能力が無く、細胞に寄生し細胞に入り込んで、その細胞の中でしか増殖できません。ウイルスに感染した細胞は、ウイルスが増殖し、多量のウイルスが細胞外に出てくるとその細胞は死滅します。感染細胞の初期からインターフェロン(IFN)が放出され、周囲の未感染細胞に感染しにくいように細胞の特性を変化させてウイルス感染の拡がりを防止します。人には、自然免疫(先天性の免疫)と獲得免疫(後天的に身につけた免疫)が備わっており、人にウイルスが感染すると、ウイルスを排除しようとこれらの免疫機能が働きます。本来、免疫とは、自身の身体の構成成分である自己と異物(病原体など)である非自己を識別することで、非自己が体内に侵入した場合、これを排除し、自己の生命の恒常性維持を図ることです。生体が、自己と非自己及び生体にとって有害か無害かを認識する機構です。
では、COVID-19を考えてみます。
1,先ず、非自己のウイルスを知っておきましょう。
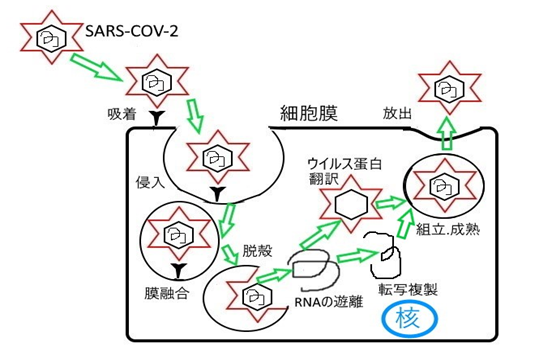
図3、5に示すようにSARS-CoV-2は、プラス鎖の一本鎖RNAを遺伝情報とする球状のエンベロープ(外膜)ウイルスです。エンベロープの表面には、王冠(コロナ)様のスパイク蛋白質があります。このスパイク蛋白質が、宿主の細胞膜上にあるACE2(アンジオテンシン変換酵素2)受容体(レセプター)に、鍵と鍵穴のように結合します。次に、タンパク分解酵素(TMPRSS2)の作用でスパイク蛋白質の一部が切断され、図4に示すように、ウイルスのエンベロープと細胞の膜が融合してSARS-CoV-2が宿主の細胞内に侵入します。その後、ウイルスは、脱殻(遺伝情報を放出)し、ウイルスの遺伝子RNAは、細胞核内に移動せず、細胞質内でウイルスRNAが複製されます。ウイルス蛋白が翻訳(合成)され、この蛋白と複製されたウイルスRNAとが結合し、成熟なウイルス粒子となり細胞外に出て、別の細胞への侵入を目指します。
2,次にウイルスと自然免疫、獲得免疫との関係について述べてみます。
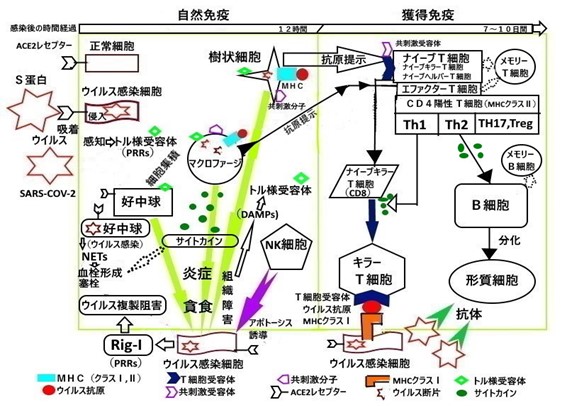
自然免疫の重要な点の一つは、ウイルス(非自己)には、ヒトなどに存在しない微生物特有の物質(病原体関連分子パターン,PAMPs)があり、免疫細胞(樹状細胞、好中球、マクロファージ等)などに存在するパターン認識受容体(PRRs)を介してウイルス(非自己)が認識され、細胞から※1サイトカインやケモカイン(白血球やリンパ球を組織へ遊走させる物質)等が誘導されるという事です。このパターン認識受容体として有名なのがトル様受容体(TLR)で、動物の細胞膜上に存在します。最近、TLR4やTLR7とSARS-CoV-2の遺伝子RNAとの関連が示され自然免疫で重要視されています。一方、正常な細胞や組織がダメージを受けたときには、損傷した細胞や細胞死などから、ダメージ(傷害)関連分子(DAMPs)と呼ばれる自己由来分子が放出され、これらのDAMPs がPRRsやDAMPs受容体を介して、細胞からサイトカインやケモカイン等が誘導されます。DAMPsは、生体の異常事態を知らせる危険シグナルとして感知され、異常事態に適切に免疫反応が作用するように調整を行い、炎症反応の誘発や組織修復などの生体反応を促進します。
そこで、SARS-CoV-2に感染する最初の部位はどこかというと、口腔粘膜や鼻粘膜です。その粘膜に侵入したウイルスをマクロファージ、好中球、樹状細胞等のトル様受容体(TLR)が感知し、これらの細胞から、抗ウイルス作用を発揮するIFNや炎症性サイトカインのIL-1、IL-6及びケモカイン等が産生分泌され炎症が起こります。これらの細胞は、特に免疫担当細胞と呼ばれ、炎症部位のバリアーとなり、ウイルスに感染した細胞を非自己として貪食(外来の微生物などの異物を呑み込み破壊する)します(図2)。
さらに重要な点の二つは、細胞膜上でなく、SARS-CoV-2の遺伝子RNAに対する細胞質内の自然免疫のセンサーの関与が明らかになりました。細胞質内に入り込んだウイルスのRNA(非自己)は、パターン認識受容体(PRRs)として機能する蛋白分子(レチノイン酸誘導遺伝子、RIG-Iやメラノーマ分化関連遺伝子5、MDA5)により、非自己として感知され、ウイルスの複製(非自己の増加)が阻害されるとの報告がされています(図2)。それ故に、PRRsやPAMPs、DAMPs、及びTLR、 RIG-I等のシグナル伝達の働きは、自然免疫には重要不可欠な存在といえます。と同時にNK細胞の存在も忘れてはならないのです。NK細胞とは、日常的に体内を監視し、ウイルス感染細胞を見つけて細胞死(アポトーシス)を誘導します(図2)。以上の自然免疫の反応により炎症やウイルス感染から回復することが出来ます。しかしながら、一般的にインターフェロンやNK細胞だけでウイルスを防御できない事が多く、自然免疫で十分対処できないために、リンパ球のT、B細胞が主役の獲得免疫が働きます。 図2に示すように、獲得免疫では樹状細胞が始動役となり、リンパ節内で※2ナイーブT細胞(これまでに抗原に出会ったことのない、起動してない状態のT細胞)にウイルスの抗原を提示します。そして、抗原の刺激を受けるとナイーブT細胞が活性化されエファクター(起動する)T細胞となりTh1細胞へ分化します。炎症局所などのTh1細胞は、サイトカインを分泌して、マクロファージを活性化し、ウイルス除去を手助けします。さらに、ナイーブキラーT細胞を活性化し、機能を発揮するキラーT細胞を誘導します。キラーT細胞は、ウイルス感染細胞の細胞膜上に提示された※3MHCクラス分子Ⅰと抗原の複合体を認識して、ウイルス感染細胞を細胞死へ誘導します。また、Th2細胞は、サイトカインを分泌してB細胞から分化した形質細胞による抗体産生を亢進させます。抗体は、ウイルスの抗原(目印)と特異的に結合し、抗原抗体反応で感染力を失わせる作用で、ウイルスを細胞内へ侵入させず、生体内から排除します。COVID-19の特徴は、ウイルス(非自己)を排除するために激しい免疫応答を示している事で、その結果、多量のサイトカインが分泌され、※4サイトカインストーム(サイトカインの嵐、または暴走)が発生し自分の細胞までも傷つけてしまいます(図1)。特に傷ついた、肺、血管、心臓、脳等での血管内では、血液凝固が促進し血栓や塞栓を形成するため生命への危険を伴います。例えば、肺のレントゲン写真やCT画像検査及び病変部の病理組織学的検査の報告では、肺組織の広範囲の炎症や損傷が認められ、激しいサイトカインストームや免疫システムの暴走が推測されます。この様な獲得免疫で殆どのウイルスは死滅しますが、それでも残念ながら、一部のウイルスは、免疫から排除されないようにウイルス自身もその生存を懸け、必死で免疫担当細胞からの攻撃を避けようと逃避します。ウイルス自体の遺伝子変異、MHCクラスⅠ分子の発現低下(ダウンレギュレーション)と変性や抗原の遮蔽及びキラーT細胞の免疫疲弊状態そして抗体や中和抗体の作用の減弱等を行います。また、MHCを選ばずに攻撃する事ができるNK細胞からも逃れようとします。このようなウイルスの免疫逃避(エスケープ)の機序は不明であり、ウイルスと宿主の相互関係の解明が急がれます。そういう訳で、今後のウイルスの治療戦略として、有効な抗ウイルス剤やワクチンの開発、有効な抗体治療の開発、免疫チェックポイント阻害剤の有効性の検討及びMHCクラスⅠ分子の発現増加の工夫等、多岐にわたる治療法が望まれます。
3,では何故、COVID-19が短期間で重症になっていくかを述べてみます。理由は4つあります。
まず、急性呼吸促迫症候群(ARDS)の出現です。ARDSとは、重症肺炎、敗血症などにより、炎症性細胞が活性化され、サイトカイン、好中球や接着分子などが複雑に関与し、肺胞や毛細血管に傷害を与え、血管内皮や肺胞上皮の透過性を亢進させます。その結果、肺胞が浸出液で満たされ、肺に水が貯まり肺水腫となり、重度の呼吸不全が引き起こされます。一般的に、原因となる疾患が発生してから24時間~48時間以内に出現すると言われ、人工呼吸器や膜型人工肺の利用なども行われ、命に関わることも少なくありません。COVID-19のARDSは、SARS-CoV-2表面のスパイク蛋白質とACE2(アンジオテンシン変換酵素2)受容体とに関係がある様です。ACE2受容体は、殆どの細胞膜上に発現していますが、特に鼻腔、気道、肺胞の上皮、小腸、大腸、などに多く発現しています。そして、ACE2の影響下で、強い血管収縮や炎症反応の惹起及び血管透過性の亢進を示すホルモンのアンジオテンシン2(Ang Ⅱ)が、アンジオテンシン(1-7,AT1-7)に変換されます。これは、血管拡張、抗炎症、抗線維化を発揮するホルモンで、Ang Ⅱの作用と反対の働きをします。また、ACE2は、膜結合型と可溶性型の2種類があり、可溶性型は血液中に存在せず、膜結合型のACE2がACE2受容体と結合して上述の機能を発揮します。そこで、ウイルスのスパイク蛋白質がACE2受容体に結合すると、ACE2は欠乏状態となります。さらに、ウイルスが細胞内に侵入し複製される過程で、図3のように細胞膜上のACE2受容体は発現低下(ダウンレギュレーション)し、結合したACE2も、分離及び変性して、アンジオテンシン2の変換ができずに過剰となってきます。即ち、アンジオテンシン2の過剰は、サイトカインストームを誘発し、肺障害を生じさせて肺水腫となります。従って、感染初期から出現しても決して不思議ではありませんので十分注意が必要です。
次に、微小血管内で血液凝固の亢進です。比較的早い時期に局所臓器の微小血管内で血液凝固の亢進が認められている事です。COVID-19の重症化や全身状態の悪化の要因は、心臓や肺の慢性疾患や糖尿病及び加齢等も考慮しなければなりませんが、特に臨床的に重要な問題となるのは、血栓や塞栓を形成し、最終的に※5DICになる事です。この原因には前述したサイトカインストームが考えられ、血液凝固を亢進させるからです。また、最近の自然免疫の新しいメカニズムとして、ACE2受容体を発現している好中球がSARS-CoV-2に直接感染し、ネトーシスと細胞外トラップを誘導し微小血管内で血液凝固を助長させていると報告されています。つまり、ネトーシスとは、ウイルスに感染した好中球が細胞内のウイルスを死滅させ、同時に好中球が自ら自爆して、死滅した細胞内の物質などを放出しウイルスを絶滅させる事です。そして、放出された物質が、粘度の高い網(net)を作り、その網で周囲のウイルスを捕獲、退治するということから、好中球細胞外トラップ(NETs)と呼ばれています。この好中球のネトーシスと細胞外トラップ現象は、色々な物質に密着し、血小板に張り付くと血小板が活性化され血栓が生じやすくなります(図2)。このようにNETsが、自然免疫の時期から出現すると生体防御に有益な正の側面とは逆に生体にとって血栓や塞栓を形成するなど不利益な負の側面をもたらし、ARDS、DIC、心筋傷害や肺血栓梗塞症などを発生させる要因ともなります。そのため、早期に血栓塞栓形成を予測する事が大事であり、重要な指標としては、Dダイマー、FDP、トロポニン、フィブリノゲン、血小板などが臨床で測定されています。
そして三つが、インターフェロン(Ⅰ型IFN)にたいする自己抗体、抗IFN自己抗体の有無が重症化リスク因子の一つであるという新しい知見が報告されています。つまり、抗IFN自己抗体がインターフェロンをブロックし抗ウイルス作用が減弱されるため重症になり易いと言われています。ウイルスとインターフェロンの関係は重要ですが、ウイルス性の慢性C型肝炎等で治療に用いられたインターフェロンは副作用が強い為に、殆ど現在では使用されなくなりました。しかしながらインターフェロンの抗ウイルス効果を考慮すると、今後の治療にインターフェロンをいかに操っていくかが興味あるところです。
最後に、間質性肺炎の存在です。肺は、肺胞というブドウの房状の袋が多数集まってできています。肺胞の薄い壁は毛細血管で取り囲まれ、肺胞と毛細血管の間でガス交換を行っています。間質とは、肺胞の壁やその支持組織を言い、そこでの炎症や損傷により壁が厚く硬く(線維化)なって、進行するのが間質性肺炎で難治性です。一方、細菌感染で起こる一般的な肺炎は、肺胞(実質)の炎症で、間質の炎症とは、部位が異なり全く別の疾患です。SARS-CoV-2は、気道上皮や肺胞上皮の細胞膜上のACE2受容体を介して細胞内に侵入し感染します。肺胞壁や肺胞内にはマクロファージ、好中球やリンパ球が常在し、ウイルスとの闘いが始まります。ここでも異常な免疫応答が繰り返されるために大量のサイトカインが分泌され、サイトカインストームで炎症や肺胞の損傷が起こります。その後、ウイルスが排除されて、炎症や組織の修復が行われます。組織修復は、始めに線維芽細胞(線維を形成する細胞)で行われ、細胞増殖因子やTGF-βの影響を受けて筋線維芽細胞となります。そして、この筋線維芽細胞が増殖し、肺の間質を埋め尽くして線維化が形成されます。その線維化が高度になると、肺胞がつぶれて組織は萎縮を起こし、ガス(酸素と二酸化炭素)交換が出来なくなり、患者は低酸素状態で呼吸困難になります。別名、広範囲な線維化をきたすことから肺線維症(肺組織が硬くなる。代表的線維化疾患としては肝硬変です)とも呼ばれます。ウイルス感染症からいつのまにか、免疫異常で発症した進行性の間質性肺炎ですが、進行を阻止する分子標的薬のチロシンキナーゼ阻害剤が開発され、COVID-19の間質性肺炎の有効な治療になるかもしれません。
4,次に全身の免疫能と治療について述べてみます。
最近の研究では、COVID-19の患者の末梢血のリンパ球、ヘルパーT細胞(CD4 T細胞)、キラーT細胞(CD8 T細胞)の細胞数は減少し、血中のサイトカイン濃度(IFN-γ,IL-2, IL-6,IL-10等)の増加が報告されています。この動態は、特に、軽症者よりも重症者に認められ、重症度と相関していることが示されています。また、ヘルパーT細胞よりもキラーT細胞の機能低下が若齢者と比較し高齢者で著明に低下しているとの報告もされています。このような研究結果は、免疫細胞が、敵(ウイルス)に向かい前線地帯を作り出し、全身から局所へ免疫細胞が動員されているかのようです。そして、図1のように重症化に伴い、全身の免疫機能は、疲弊、枯渇し最後には崩壊していくのではないかと推測されます。
入院が必要になった重症患者の治療について、米国でのガイドラインでは、全身ステロイド治療や抗IL-6抗体の治療及び血栓塞栓症の予防と治療での抗凝固療法が推奨されています。即ち、サイトカインストームには免疫抑制剤治療、IL-6の炎症性サイトカインには、IL-6レセプターに対するモノクローナル抗体の治療、そして血栓塞栓症には抗凝固療法に重点が置かれ、ウイルスを撃退する薬(抗ウイルス薬)はさほど重要視はされていません。その理由は、図1に示すように、発症早期はウイルス量が多く、早期からの抗ウイルス薬の効果は期待できるものの、発症10日以降では、ウイルスが殆ど消失していることから、発症10日以降で重症化した患者での抗ウイルス薬は、効果が乏しかったのではないかと考えられるからです。
5,終わりに、SARS-CoV-2の免疫は、自己と非自己との認識を超えた、生命の起源と進化を感じます。
SARS-CoV-2は、遺伝子の変異も重なり、COVID-19は、様々な病態を作り出していくのが特徴的で、未だに不明な点が多い。今後も出現する新種のウイルスに対してもCOVID-19のさらなる研究を重ね、医療関係者や科学者達の知恵を絞り、このウイルスの収束を目指して研究開発を継続していかねばならないと痛感します。
補足説明
※1 サイトカイン:
サイトカインとは、侵入した病原体に応答して細胞から産生され、 免疫細胞を刺激、動員、および増殖させると同時に細胞と細胞の間の情報伝達を行います。細胞間相互の重要な調節因子のタンパク質の総称で、インターロイキン(IL)、ケモカイン、腫瘍壊死因子(TNF)およびインーフェロンなどがあります。その数種類は、発熱や炎症反応などを引き起こす炎症性サイトカインがあり、その代表的な生理活性物質が、IL-1、IL-6(インターロイキン1、6)腫瘍壊死因子(TNF-α)等です。IL-6やTNF-αは、微小血栓の形成や血液凝固を促進させます。インーフェロン(IFN)は、ウイルスを増殖抑制的に働きます(抗ウイルス作用)。一方、炎症を抑制する抗炎症性サイトカインのIL-10(インターロイキン10)やTGF-β(形質転換増殖因子)等が存在します。このような炎症性サイトカインと抗炎症性サイトカインは、生体の免疫調整に関与し、このバランスが崩れると自己免疫疾患が発生すると言われています。
※2 ナイーブT細胞:
まだ抗原に出会ったことのない、起動してない状態のT細胞のことで、抗原提示細胞からの刺激で活性化され、Th1やTh2細胞などのエファクターヘルパー(起動する)T細胞に分化します。
※3 MHC:
主要組織適合性複合体と言い、MHC分子と表現され非自己組織の拒絶に関する遺伝子領域です。ヒトではHLAと名付けられ、HLA(MHC)が異なる臓器移植の拒絶反応の理由は、T細胞が移植された臓器を非自己と認識するためと考えられています。そして、MHC分子には2種類があり、それぞれクラスⅠとクラスⅡが存在し、キラーT細胞は、細胞膜上に発現したMHCクラスⅠ分子と抗原を認識、ヘルパーT細胞は、MHCクラスⅡ分子と抗原を認識します。キラーT細胞やNK細胞は、ウイルスそのものを死滅させるのでなく、ウイルスに感染した細胞を細胞死させます。
※4 サイトカインストーム:
感染症や薬剤投与などの原因により、血中サイトカイン(IL-1,IL-6,TNF-αなど)の異常上昇で、その作用が全身に波及した結果、血液の凝固の亢進や好中球の活性化及び血管拡張などを介して、ショック、※DIC、多臓器不全にまで進行する状態を言います。制御不能なサイトカインが放出され続け、自分の細胞までを傷つける現象から、別名、サイトカイン放出症候群とも呼ばれます。
※5 DIC(播種性血管内凝固症候群):
血管内に血栓が無数に出来る事で、小さな血管が詰まり、出血を止める血小板や凝固因子を使い果たして過度の出血を引き起こす状態を言います。
COVID-19のまとめ
1,患者の約80%は、無症状か軽症で経過しますが、約20%が重症肺炎となり、約5~6%が致死的な急性呼吸促迫症候群(ARDS)となります。日本の感染者の致死率は、約0.2%です。
2,急性呼吸促迫症候群(ARDS)は、SARS-CoV-2表面のスパイク蛋白質が細胞のACE2(アンジオテンシン変換酵素2)受容体と結合し、アンジオテンシン2が過剰となり発生すると考えられます。
3,サイトカインストームやNETs で早期に微小血管内で血液凝固が亢進し、血栓や塞栓が発生することがあるので要注意です。
4,間質性肺炎は、SARS-CoV-2に対しての異常な免疫応答で発症すると考えられます。
5,重症例の治療は、全身ステロイド治療や抗IL-6抗体の治療及び血栓塞栓症の予防と治療での抗凝固療法が推奨されています。


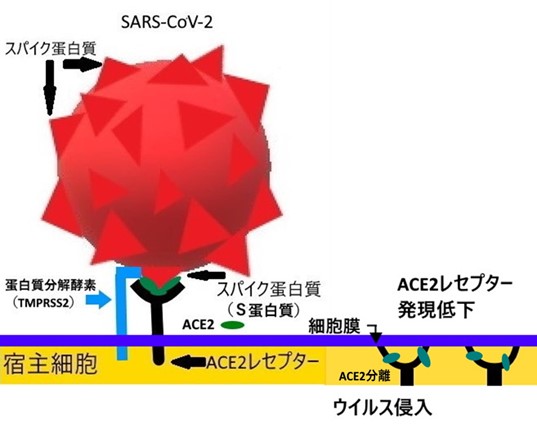

ウイルス侵入時のACE2受容体*ACE2(アンジオテンシン変換酵素2)

COVID-19の検査法
COVID-19検査は、抗原検査法、 PCR(リアルタイムPCR)検査法、抗体検査法があります。
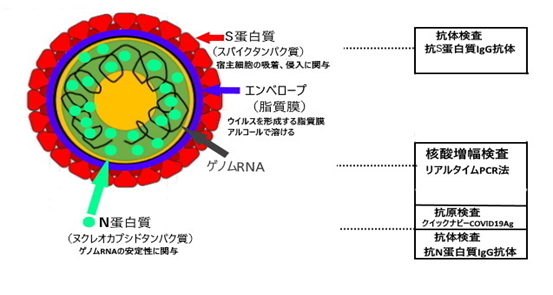

抗体検査法
抗N蛋白質IgG抗体 過去に感染したかの判定。ワクチン接種の効果判定に不適です。
抗S蛋白質IgG抗体 現在の抗体量、ワクチン接種後等の抗体価を示す。
感染しにくい状態かの判定。抗体が陽性でも再感染の可能性があります。
当院での検査法及び対処の方法を説明します。
発症者は、原則として7~10日間の経過観察、または、症状によりますが入院となります。
SARS-COV-2(ウイルス)の量、抗体の量は、症状の軽快や治癒に関係します。
1,体温が38度以上の方は抗原検査をします。(定性試験、約15分程度で判明)
COVID-19 抗原検査
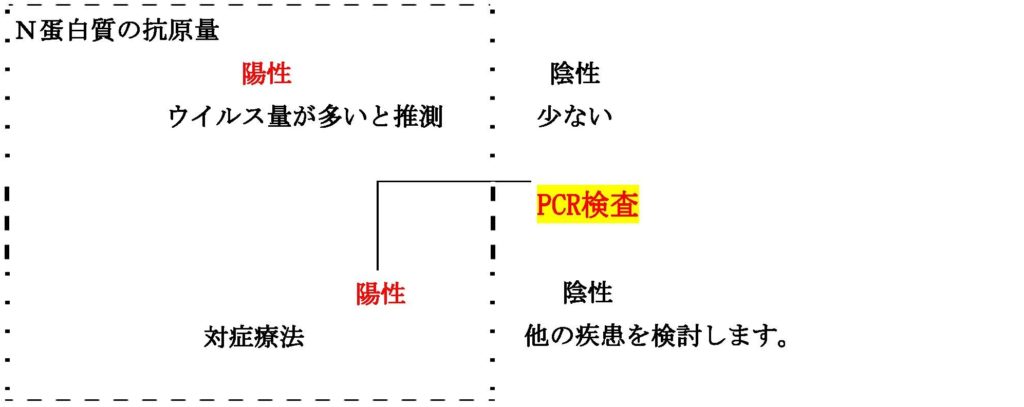

抗原検査陽性は、約10日間頃より陰性となります。
2,体温が38度以下、風邪症状、全身倦怠感、息切れ、味覚・嗅覚障害、腹痛、下痢などの症状の方は、PCR検査をします。
・COVID-19 抗原検査では陰性が多い。
・COVID-19 PCR検査を優先します。


1、2で軽症の患者さんの治療は、自宅待機での対症療法が中心です。約8割が軽症で自然治癒します。
PCR検査陽性は、長引く事があり、誤解を招く恐れがあります。
3,重症、中等症の患者さん、特に呼吸不全、間質炎肺炎、DIC(播種性血管内凝固症候群)や多臓器不全に移行する場合は、入院治療が必要です。
軽症例の大半は自然治癒するため、各薬剤の適応に従う。重症化リスクが高い場合に入院と薬物治療を検討します。
COVID-19に対する薬物治療は、①抗ウイルス薬・抗体薬、②免疫調整薬・免疫抑制薬、③抗凝固薬、④その他に大別されます。
呼吸不全は、酸素投与、人工呼吸器管理又は体外式膜型人工肺(ECMO)の導入で管理します。
尚、法改正が施行される予定です。
詳細は、以下を参照にしてください
新型コロナウイルス最前線 – 厚生労働省https://www.mhlw.go.jp/stf/houdou_kouhou/kouhou_shuppan/magazine/202110_00003.html
新型コロナウイルス感染症対策の基本的対処方針変更
https://corona.go.jp/expert-meeting/pdf/kihon_h_taishou_20220523.pdf
を参考にしてください
新型コロナウイルス感染症COVID-19診療の手引き 第7.2版(2022年5月9日掲載)https://www.mhlw.go.jp/content/000936655.pdf